
题目列表(包括答案和解析)
| A、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | B、第二周期元素从左到右,最高正化合价从+1递增到+7 | C、同主族非金属元素的简单阴离子的还原性越强,其元素非金属性越强 | D、同周期金属元素的最外层电子数越多,其原子失电子能力越强 |
| A、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | B、某元素X的气态氢化物的化学式为H2X,则其最高价氧化物的化学式为XO3 | C、同主族非金属元素的简单阴离子的还原性越强,其元素非金属性越强 | D、同周期金属元素的最外层电子数越多,其原子失电子能力越弱 |
下列有关元素的性质及其递变规律正确的是
A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键
B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1
C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱
D.同周期主族金属元素的化合价越高,其原子失电子能力越强
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液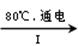 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com