
题目列表(包括答案和解析)

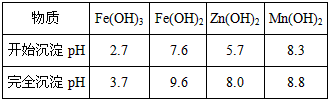
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 9.8 |
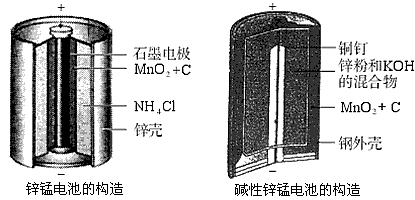
(10分)请仔细观察两种电池的构造示意图,完成下列问题:
锌锰电池的构造 碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
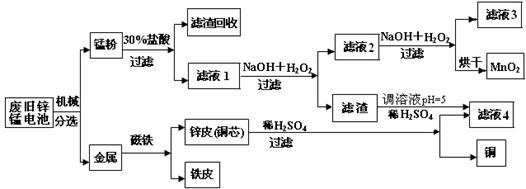
(3)某工厂回收废旧锌锰电池,其工艺流程如下: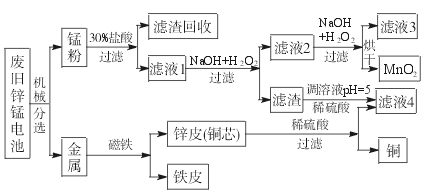
已知:生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 8.8 |
(10分)请仔细观察两种电池的构造示意图,完成下列问题:

锌锰电池的构造 碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
8.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
(10分)请仔细观察两种电池的构造示意图,
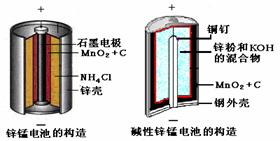
回答下列问题:
(1)碱性锌锰电池的总反应式:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,
则负极的电极反应式:
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是
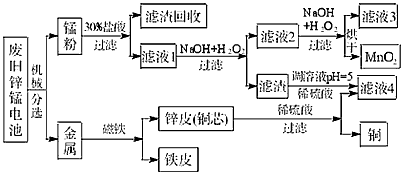
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
已知:生成氢氧化物的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH | 3.7 | 9.6 | 8.0 | 9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2 。
②第一次加入H2O2后,调节pH=8.0。目的是 。
③试列举滤液4的应用实例 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com