
题目列表(包括答案和解析)
光气(COCl2)在塑料等工业中有许多用途,COCl2的分解反应为:COCl2(g)  Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
①比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)
②比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率
[分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
③比较第14min时,使平衡移动采取措施可以是
④比较第8 min和第16min时,平衡常数K值(分别用K8,K16表示)大小关系是
⑤COCl2在达平衡时的转化率中最大的是第 min(范围)
⑥计算出第4min之后再达平衡的混合气体中,平均相对分子质量最大数值是 
汽油是C5~C10烷烃组成的混合物,其平均分子式可写为C8H18.汽油不完全燃烧的化学方程式为:2C8H18+23O2![]() 12CO2+4CO+18H2O.当人体吸入CO后,与空气中的O2及人体的血红蛋白Hem建立平衡:CO+HemO2
12CO2+4CO+18H2O.当人体吸入CO后,与空气中的O2及人体的血红蛋白Hem建立平衡:CO+HemO2![]() O2+HemCO.在人体内此平衡存在如下关系:([O2][HemCO])/([CO][HemO2])=210,当[HemCO]为[HemO2]的2%时,人的智力将受到严重损伤.某40万人口的中等城市,能有效利用标准状况下的空气为2.24×106m3,O2约占空气体积的21%,以每辆汽车满负荷行驶,每天约有28.5g汽油不完全燃烧,此城市若达到中等发达国家水平,以40万人计平均每10人有1辆汽车.试通过计算求:
O2+HemCO.在人体内此平衡存在如下关系:([O2][HemCO])/([CO][HemO2])=210,当[HemCO]为[HemO2]的2%时,人的智力将受到严重损伤.某40万人口的中等城市,能有效利用标准状况下的空气为2.24×106m3,O2约占空气体积的21%,以每辆汽车满负荷行驶,每天约有28.5g汽油不完全燃烧,此城市若达到中等发达国家水平,以40万人计平均每10人有1辆汽车.试通过计算求:
(1)空气中含有O2的物质的量.
(2)当人的智力将不会受到严重损伤时,CO与O2的浓度之比.
(3)该城市汽车的最高利用率.
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。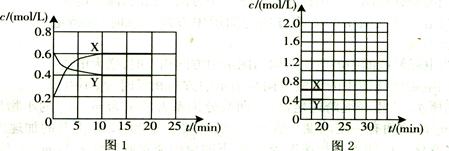
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
Ⅰ、(4分)将0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况
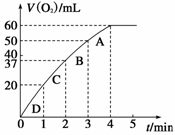 下放出气体的体积和时间的关系如图所示。解释反应速率变化的
下放出气体的体积和时间的关系如图所示。解释反应速率变化的
原因: ;计算H2O2的初
始物质的量浓度为 。(保留两位有效数字)
Ⅱ、(8分)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。
(2)若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
(3)若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0,。请用p0、p来表示达平衡时反应物A的转化率а(A)为 。
(4)能够说明该反应达到平衡的标志是( )
A.容器内混合气体的密度保持不变 B.v(A)=3v(B) C.A、B的浓度之比为3:1
D.单位时间内消耗3n molA的同时生成n molB E.混合气体的平均相对分子质量

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com