
题目列表(包括答案和解析)
有关元素A、B、C、D、E的信息如下:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子中含10个P电子 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
 (1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________。
①A+B![]() M+D+E;②M+E
M+D+E;②M+E![]() A+F+B。请针对以下两种不同情况完成下列问题:
A+F+B。请针对以下两种不同情况完成下列问题:
(1)若A是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为________________;反应②的离子方程式为________________;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为________________________________________________。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,则X在元素周期表中的位置是________________。X单质的熔点是112.8 ℃,则X单质的晶体类型属于________________晶体。以石黑作电极电解A溶液,电流强度为a A,时间t min 后阴极增重w g,在阳极得V L纯净气体,则阿伏加德罗常数NA的计算式是(1个电子的电荷量为q C)_________________________。
下图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表,电解一段时间t1后,将CO2连续通入电解液中,请在右下图中完成左下图实验中电流对时间的变化关系图,并填空回答:
 |

(1)电解时,F极发生 反应,电极反应式为 ;E极发生 反应,电极反应式为 ,电解总反应式 。
(2)电解池中产生的现象:① ;② ;③ 。
下图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入到电解液中。
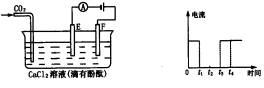
(1)请在右图中完成左图实验中电流对时间的变化关系图。
(2)电解时,F极的电极反应式为________,
电解总反应式为________________。
(3)电解池中产生的现象:
①__________________________________
②__________________________________
③__________________________________

(1)请在右图中完成左图实验中电流对时间的变化关系图。
(2)电解时,F极的电极反应式为________,
电解总反应式为________________。
(3)电解池中产生的现象:
①__________________________________
②__________________________________
③__________________________________
第Ⅰ卷(选择题,共63分)
一二.选择题。(3’×9+4’×9)
题号
1
2
3
4
5
6
7
8
9
答案
A
C
D
B
D
C
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
D
AC
B
AC
BC
B
C
CD
A
第Ⅱ卷(非选择题,共83分)
三.(本题包括3小题,共32分)
19.(9分)(1)双氧水(1分),Na2O2(其它合理答案也可)(1分)(2)a(1分)
(3)吸收多余氯气,防止污染空气。(2分)
(4)洗气瓶.安全瓶(其它合理答案也可)(各2分,共4分)
20.(11分)(1)固体完全溶解,溶液呈血红色(2分) (2)ABC(3分)
(3) Fe2O3+6H+===2Fe3++3H2O Cu2O+2H+===Cu+Cu2++H2O 2Fe3++Cu===2Fe2++Cu2+(每个离子方程式2分,共6分)
21.(12分)(1)B.锌粒(1分) C.水(1分) D.浓硫酸(1分)
(2)检查气密性(1分) 将G弯管浸没在盛有水的烧杯中,关闭分液漏斗活塞,温热烧瓶B,观察G管口,若有气泡逸出,停止加热后,G管倒吸形成一段水柱,说明装置的气密性良好(2分)(3)先从A瓶逐滴滴加液体(1分) 检验H2的纯度(1分)
(4)氢气(1分) 在G管出口处点燃(1分)
(5)
 或
或  (2分)
(2分)
四.(本题包括3小题,共31分)
22.(8分)(1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O。(2分) (2)酸性;氧化性(2分) (3)0.6 mol(2分) (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。(2分)
 23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O
23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
24.(9分)(1)
(2)氧化.2Cl-+2e-=Cl2↑;
CaCl2+2H2O=Ca(OH)2+Cl2↑+H2↑;
(3)①F极放出黄绿色气体,E极放出无色气体;
②E极附近溶液变为红色;
③溶液变浑浊
五.(本题包括1小题,共10分)
25.(10分)29.(1) E F(2分)(2) ①③(2分)
 (3)A.CH3CH=CH2 ,
I.
(3)A.CH3CH=CH2 ,
I. 。(4分)
。(4分)
(4)(2分)
六.(本题包括2小题,共10分,任意选做一题,如果两道题都做,则按第26题给分)
26.⑴酯基.碳碳双键.苯环(3分)⑵加成(加聚)(2分)⑶(3分)
|