
题目列表(包括答案和解析)
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
 .?
.?
| ||
| ||
SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
⑶若2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
A.Q1 = 2Q2 = 2Q3 = 197kJ
B.在上述反应中每消耗2mol SO2气体时放出的热量为197kJ
C.在上述反应中生成1mol SO3气体放热98.5kJ
D.2Q1 ??= 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
![]()
![]()
下列措施中能提高燃煤烟气中![]() 去除率的有 (填字母)。
去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
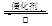 2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
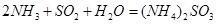
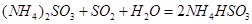
下列措施中能提高燃煤烟气中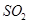 去除率的有
(填字母)。
去除率的有
(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
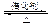 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 |
| 0 | Q2 |
丙 | 0 | 0 | 1 | Q3 |
 2 < Q3 < 197kJ
2 < Q3 < 197kJ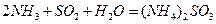
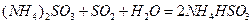
 提高燃煤烟气中
提高燃煤烟气中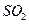 去除率的有 (填字母)。
去除率的有 (填字母)。一、选择题(每小题只有一个正确选项,每题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
C
C
B
B
D
D
C
B
A
C
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
B
A
C
D
D
C
B
D
C
D
B
二、填空题(共50分)
26、(10分)
①离子方程式为 Al(OH)3+OH-=AlO2-+2H2O ②电子式为 
③显 酸 性;原因 Al3++SH2O Al(OH)3+3H+
Al(OH)3+3H+
④化学方程式为 SO2+Cl2+2H2O=2HCl+H2SO4
⑤稳定性 HCl > H2S
27、(6分)
肯定有的离子 K+、AlO2-、CO32- ;肯定不存在的离子 NH4+、Al3+、SO42-
 是否有Cl- 有
是否有Cl- 有
 28、(10分)
28、(10分)
 (1)A
B
(1)A
B
 |

 (2)化学方程式①
(2)化学方程式①
② ③反应类型是 消去
29、(14分)
I: 制硝酸 制化肥
II: ② ④
Ⅲ:①目的 防止不钝的氢气加热不安全
②现象是 固液脱离接触
原因是 以大氢气的浓度提高N2转化率
气体成分是 N2、H2
③原因是 铁触媒在较高温度时活性大,加快氨合成速率
化学方程式 
四、计算题(共10分)
30、(10分)
 ①
① 
② 0.025
③ 0.005 0.005
④ 0.005mkx<0.015ml
 天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
|