
题目列表(包括答案和解析)
 (2013?大兴安岭)学完酸碱盐知识后,小美对妈妈焙制糕点用的小苏打很感兴趣,她把小苏打带到实验室与小刚一起进行探究.
(2013?大兴安岭)学完酸碱盐知识后,小美对妈妈焙制糕点用的小苏打很感兴趣,她把小苏打带到实验室与小刚一起进行探究.| 操作步骤 | 实验现象 | 结论 |
| 取少量白色固体于试管中,加水溶解,向其中滴加 氯化钙 氯化钙 溶液 |
产生白色沉淀 | 试管内剩余的固体为Na2CO3 |
| ||
| ||

| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
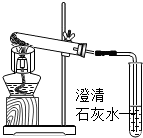
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气. 观察装置B、装置C中的现象 |
装置B中的现象是: 黄色试纸变蓝 黄色试纸变蓝 装置C中的现象是: 澄清石灰水变浑浊 澄清石灰水变浑浊 |
聚乙烯塑料在空气中燃烧,生成碳的氧化物中,既有CO2,也有CO. 装置C中反应的化学方程式为: CO2+Ca(OH)2=CaCO3↓+H2O CO2+Ca(OH)2=CaCO3↓+H2O |
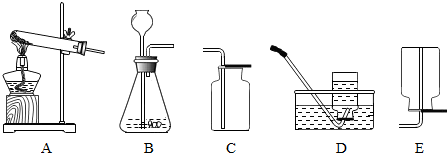
 、
、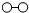 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:


| ||
| ||

| 实验一 | 实验二 | 实验三 | |
实验 方案 |
 |
 |
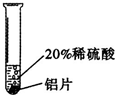 |
| 实验 现象 |
铬片表面产生气泡缓慢,溶液变蓝色. | 无明显现象 |
铝片表面产生气泡较快. |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 Al Cr Cu | |||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com