
题目列表(包括答案和解析)
 2NO(g)的平衡常数K如下表
2NO(g)的平衡常数K如下表 

 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)  2NO(g)的平衡常数K如下表
2NO(g)的平衡常数K如下表 

 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应________.(填字母)
A.所需的活化能很高
B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)
2NO(g)
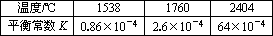
①该反应的ΔH________0.(填“>”、“=”或“<”)
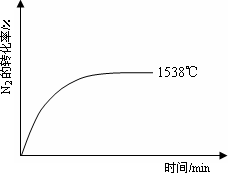
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)
一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是________.A.降低温度
B.加催化剂
C.增加压强
D.增加O2浓度
E.分离出一氧化氮
(4)2404℃
时,在容积为1.0 L的密闭容器中通入2.6 mol N2和2.6 mol O2,计算反应N2(g)+O2(g)(5)
NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).且:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534 kJ/mol
N2(g)+2H2O(g) ΔH=-534 kJ/mol
请写出肼与NO2反应的热化学方程式________.
 在2L密闭容器中反应2NO2(g)
在2L密闭容器中反应2NO2(g)  2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题: 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com