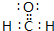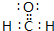(I)多项选择题
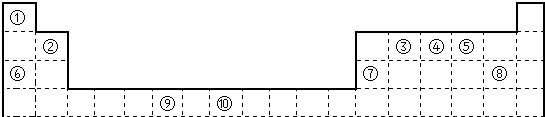
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是
ABC
ABC

A.a图表示第三周期元素的原子半径(稀有气体除外)
B.b图表示ⅡA族元素的最外层电子数
C.c图表示第二周期元素的电负性(稀有气体除外)
D.d图表示第三周期元素的第一电离能(稀有气体除外)
E.e图表示第ⅦA族元素氢化物的沸点
(II)
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO
4?5H
2O可写成[Cu(H
2O)
4]SO
4?H
2O,其结构示意图如下:

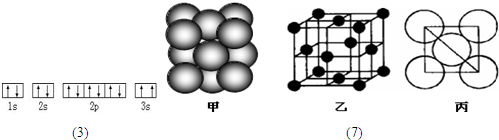
(1)写出铜原子价层电子的轨道排布式
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有
K、Cr
K、Cr
(填元素符号).
(2)由上图可知:胆矾中存在的作用力有
abcd
abcd
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO
4溶液中加入过量较浓的NH
3?H
2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C
2H
5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH
3)
4SO
4?H
2O晶体.实验中所加C
2H
5OH的作用是
加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,便于析出
加C2H5OH,减小“溶剂”(C2H5OH和H2O)的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,便于析出
.
(4)已知Cu(NH
3)
42+呈平面正方形结构,则Cu(NH
3)
4SO
4?H
2O晶体中呈正四面体的粒子是
SO42-
SO42-
,杂化轨道类型是sp
3的原子有
N、S、O
N、S、O
.
(5)如将深蓝色溶液加热,可能得到什么结果?
加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4
加热,NH3挥发,生成Cu(OH)2蓝色沉淀和(NH4)2SO4
.