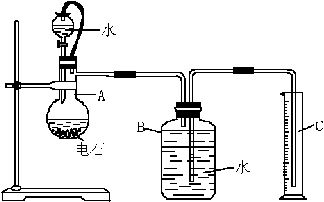
某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+2H
2O+SO
2↑
Cu+2H
2SO
4(浓)
CuSO
4+2H
2O+SO
2↑
,试问:为什么较多的余酸不再与铜片继续反应?简述理由:
铜片过量,硫酸反应后溶液变稀不支持反应
铜片过量,硫酸反应后溶液变稀不支持反应
.
可以证明有余酸的实验方案是
ad
ad
(填写字母,错选或多选扣分)
(a)再加入铁粉(b)再滴入BaCl
2溶液(c)再加入银(d)再滴入Na
2CO
3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是
ac
ac
(填写字母,错选或多选扣分)
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl
2溶液,过滤、洗涤、干燥、称量沉淀.
(c)用排水法测定其产生气体的体积(折算成标准状况).
(d)用排饱和NaHSO
3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu
2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na
2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式:
Cu2++S2-═CuS↓
Cu2++S2-═CuS↓
.
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是
反应后溶液的体积
反应后溶液的体积
.
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度=
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
mol/L(用含W.V的代数式表示)