
题目列表(包括答案和解析)
在100℃时,将0.100 mol的N2O4气体充入1 L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
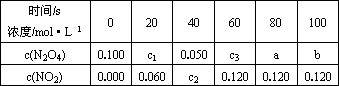
试填空:
(1)达到平衡时N2O4的转化率为________%,表中c2________c3,a________b(选填“>”“<”“=”).
(2)20 s的四氧化二氮的浓度c1=________mol·L-1,在0-20 s内四氧化二氮的平均反应速率为________mol·(L·s)-1.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是________mol·L-1.
(12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4 2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
(12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)(mol) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)(mol) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4 ![]() 2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O??4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
时间/s 浓度 mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为______________________________;达到平衡时四氧化二氮的转化率为__________%;表中c2__________c3__________ab__________(选填“>”“<”或“=”)。
(2)20 s时四氧化二氮的浓度c1=_________mol·L-1,在0~20 s内四氧化二氮的平均反应速率为________________mol·(L·s)-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是______________mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com