
题目列表(包括答案和解析)
根据化学实验仪器的特征和用途回答下列问题:
(1)下列仪器中,根据物质的沸点不同分离物质时需要的是(填编号)________.
①容量瓶 ②普通漏斗 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙 ⑧温度计 ⑨干燥管
(2)实验室里不同化学试剂的保存方法不尽相同.下图中的A、B、C、D、E是常见的一些保存药品的试剂瓶.请把下列常见试剂的序号填写在各试剂瓶下面的括号内.
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦氯水 ⑧浓硝酸

(3)对于下列仪器,用序号回答有关问题:
①容量瓶 ②蒸馏烧瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥蒸发皿 ⑦分液漏斗
对允许加热的仪器,加热时必须垫石棉网的是________;使用时必须检查是否漏水的是________;标有“0”刻度的有________.
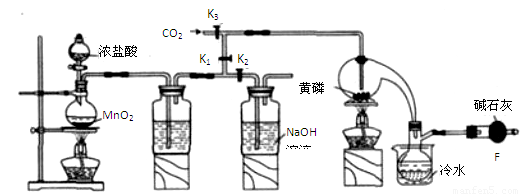
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
??????? A???????????? B?????????? C????????????? D?????? E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5? PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为?????????????????????????????????? 。
(2)B中所装试剂是??????????????????? ,
E中冷水的作用是 ??????????????????????????????????????????????????
F中碱石灰的作用是_____??????????????????????????????????????????????????
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 ????????????????? 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40mL
已知:H3PO3+H2O+I2== H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
2008年5月12日,我国汶川发生大地震.全国人民“众志成城,抗震救灾”.
(1)“拯救生命是第一位的”.为搜救埋在废墟下的幸存者,调用了许多搜救犬.搜
救犬能根据人体发出的气味发现幸存者.从微观的角度分析搜救犬能发现幸存者的
原因是________.
A.分子的质量很小 B.不同分子性质不同
C.分子不断运动 D.分子间有间隔
(2)地震中许多原有的水源被破坏.新水源需检测和处理后才能成为饮用水.我国规
定水质必须在感官性指标、化学指标、病理学指标等方面均达标方可成为生活饮用
水.
①感官性指标中有一项要求:不得含有肉眼可见物,水应澄清透明.为达到此要求,
净化水时,可以通过加入絮凝剂凝聚、沉降,然后通过________(填操作名称)而实
现.
②化学指标中含有水源的pH和硬度两项.
测定液体pH的方法是___________________________________________________
_______________________________________________________________________.
日常生活中如何区分硬水与软水?请简述实验步骤与现象:
______________________________________________________________________
______________________________________________________________________.
③病理学指标中对细菌的含量有严格的限制.要杀灭细菌可以向水中加入________
等消毒剂,也可以通过________操作,既杀灭细菌,又能得到几乎纯净的水.
(3)为防止灾后疫情的发生,某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液
对灾民的居住环境进行消毒.要配制溶质质量分数为0.5%的过氧乙酸溶液300 kg,
需溶质质量分数为15%的过氧乙酸溶液______kg,配制的主要步骤是:__________、
__________、__________.
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
A B C D E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com