
题目列表(包括答案和解析)
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
|
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
|
沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
|
平行测定数据 |
平均值 |
|||
|
实验编号 |
1 |
2 |
3 |
4 |
|
|
消耗H2O2溶液的体积/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
(Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)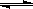 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g) 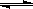 2NO(g)达到平衡时NO的浓度为
。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为
。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)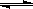 C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
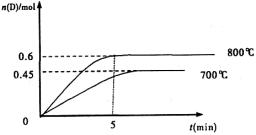
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数
K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g) 2NO(g)达到平衡时NO的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数
K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
| Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
| 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s) Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
有X、Y、Z三种常见元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
⑴Y的最高价氧化物对应水化物的化学式是 。
⑵将ZY3溶液滴入沸水可得红褐色液体,
反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
⑶X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol 该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
②该无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com