
题目列表(包括答案和解析)
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
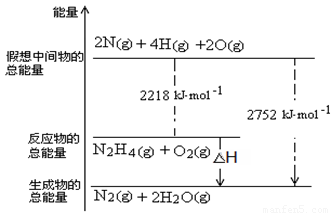
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式 。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1 B.w3=w1 C.2ρ1=ρ2 D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
(12分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:

① 试管中(填产生沉淀或气体及反应速率等相关现象)___________ _。
② 盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③ 甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2g Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL 稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL 稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL 稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL 稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《_____________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写):
a:NaHCO3的溶解是_______过程;
b:Na2CO3的溶解是_______过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。
(12分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
① 试管中(填产生沉淀或气体及反应速率等相关现象)___________ _。
② 盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③ 甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL 稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《_____________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写):
a:NaHCO3的溶解是_______过程;
b:Na2CO3的溶解是_______过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。
(12分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)___________ _。
②盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL 稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL | 滴定前刻度 | 滴定后刻度 | 1 | 10.00 | 1.02 | 21.03 | 2 | 10.00 | 2.00 | 21.99 | 3 | 10.00 | 0.20 | 20.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com