
题目列表(包括答案和解析)
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 2CO(g),K1
CO(g)+H2O(g) H2(g)+CO2(g),K2
C(s)+H2O(g) CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g)2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g) 2N2(g) + 3H2O(g)
以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 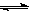 2CO(g),K1
2CO(g),K1
CO(g)+H2O(g) 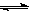 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g) 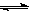 CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g) 2NO2(g)-Q(Q>0),在温度
2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。

A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)

以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com