
题目列表(包括答案和解析)
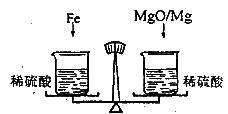
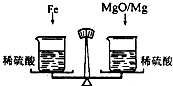 (2006?宜宾)在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为
(2006?宜宾)在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为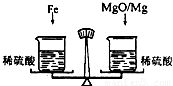

在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向 左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为 ( )
A.14:1 B.14:3 C.28:5 D.28:19
在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比为 .

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com