
题目列表(包括答案和解析)
今有一反应,aA+bBƒC,在25℃时,将A、B溶液按不同浓度混合,得到下列实验结果:
A的浓度mol×L-1 B的浓度mol×L-1 反应速度v(mol×L-1×s-1)
1.0 1.0 1.2´10-2
1.0 4.0 1.92´10-1
4.0 1.0 4.8´10-2
分析以上数据,求出a、b的值。
经长期实践,人们总结出反应速率和反应物浓度之间存在定量关系:恒温下,对简单反应来说,化学反应速率同反应物浓度的方次的乘积成正比(反应物浓度的方次等于反应方程式中各物质的计量数)。如对于反应mA+nBƒC来说,v=kcm(A)×cn(B),其中k为常数。
今有一反应,aA+bBƒC,在25℃时,将A、B溶液按不同浓度混合,得到下列实验结果:
A的浓度mol×L-1 B的浓度mol×L-1 反应速度v(mol×L-1×s-1)
1.0 1.0 1.2´10-2
1.0 4.0 1.92´10-1
4.0 1.0 4.8´10-2
分析以上数据,求出a、b的值。
| 实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、实验2,HBr的初始浓度C2=1.0 mol/L |
| B、从上表数据分析,2HBr?Br2+H2正反应为放热反应 |
| C、实验4一定使用了催化剂 |
| D、实验3的反应速率大于实验1的反应速率 |
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 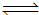 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)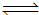 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)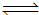 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)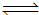 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。


图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③ D.N2的转化率:② > ① > ③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com