
题目列表(包括答案和解析)
下列说法正确的是
A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g)
+ 3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.对于可逆反应N2(g)+3H2(g)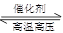 2NH3(g)
△H﹤0,升高温度,可使反应速率增大,反应逆向移动
2NH3(g)
△H﹤0,升高温度,可使反应速率增大,反应逆向移动
D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g)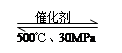 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.对于可逆反应N2(g)+3H2(g)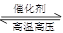 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
(1)A、B、C、D分别是___________、___________、___________、___________。
(2)A离子的结构示意图为___________。
(3)C原子的结构示意图为___________。
(4)C的最高价氧化物对应水化物与A的氢氧化物反应最多生成___________种盐,其化学式为______________________。
(5)C、D的气态氢化物稳定性由强到弱的顺序为______________________。
A、B、C、D四种元素的原子序数均小于18,其最高正价依次为+1,+4,+5,+7,已知B的原子核外次外层电子数为2,A、C原子的核外次外层电子数均为8,D元素的最高价氧化物对应水化物在含氧酸中的酸性最强,则:
(1)A、B、C、D分别是________、________、________、________.
(2)A离子的结构示意图为________.
(3)C原子的结构示意图为________.
(4)C的最高价氧化物对应水化物与A的氢氧化物反应最多生成________种盐,其化学式为________.
(5)C、D的气态氢化物稳定性由强到弱的顺序为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com