
题目列表(包括答案和解析)
下列方法能使电离平衡H2OH++OH—向右移动,且使溶液呈酸性的是 ( )
A、向水中加入少量硫酸氢钠固体 B、向水中加入少量硫酸铝固体
C、向水中加入少量碳酸钠固体 D、将水加热到100℃,使水的PH=6
【解析】考查外界条件对平衡的影响。由于水既能电离出氢离子,又能电离出OH-,所以不论是酸还是碱均能抑制水的电离,A不正确。盐类的水解可以促进水的电离,B中水解显酸性,C中水解显碱性,B正确,C错误。温度升高可以促进水的电离,但纯水在任何温度下都是显中性的。答案选B。
下列方法能使电离平衡H2O H++OH—向右移动,且使溶液呈酸性的是 ( )
H++OH—向右移动,且使溶液呈酸性的是 ( )
A、向水中加入少量硫酸氢钠固体 B、向水中加入少量硫酸铝固体
C、向水中加入少量碳酸钠固体 D、将水加热到100℃,使水的PH=6
【解析】考查外界条件对平衡的影响。由于水既能电离出氢离子,又能电离出OH-,所以不论是酸还是碱均能抑制水的电离,A不正确。盐类的水解可以促进水的电离,B中水解显酸性,C中水解显碱性,B正确,C错误。温度升高可以促进水的电离,但纯水在任何温度下都是显中性的。答案选B。

| A烧瓶中 | B烧瓶中 | 20℃、101kPa量筒(50ml)内气体体积 | 反应时间 | |
| A瓶 | B瓶 | |||
| 40ml0.1mol/L CH3COOH溶液 |
40ml0.1mol/L 盐酸溶液 |
5ml | t(a1)=155s | t(b1)=7s |
| 10ml | t(a2)=310s | t(b2)=16s | ||
| 15ml | t(a3)=465s | t(b3)=30s | ||
| 20ml | t(a4)=665s | t(b4)=34s | ||
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

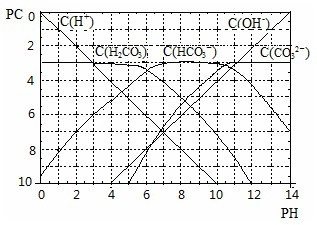


(16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是 ,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。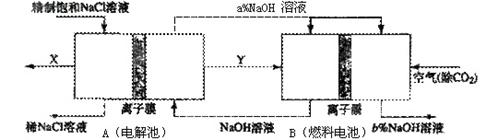 ①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
②这样设计的主要节(电))能之处在于 (至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行? (填可行或不可行),理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com