
题目列表(包括答案和解析)

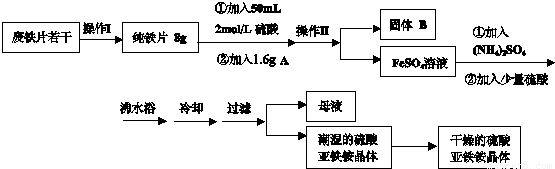
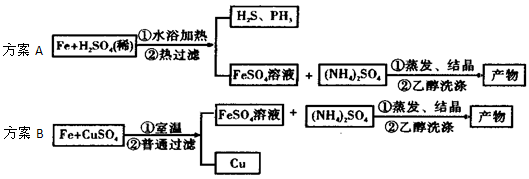


下列各组离子在常温下一定能大量共存的是
A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+
B.在c(H+)=10-2 mol·L-1的溶液中:NH4+、NO3-、K+、Cl-
C.加入铝粉能放出H2的溶液中:Ba2+、NH4+、NO3-、Cl-
D.含有大量Cu2+的溶液中:Al3+、S2-、Br-、Na+
【解析】亚铁离子是浅绿色的,A错误。加入铝粉能放出H2的溶液可以是酸性溶液,也可以是碱性溶液,碱性溶液中NH4+不能大量共存,C不正确。铜离子和硫离子不能大量共存,且硫离子和铝离子也不能大量共存,所以正确的答案是B。
下列各组离子在常温下一定能大量共存的是
A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+
B.在c(H+)=10-2 mol·L-1的溶液中:NH4+、NO3-、K+、Cl-
C.加入铝粉能放出H2的溶液中:Ba2+、NH4+、NO3-、Cl-
D.含有大量Cu2+的溶液中:Al3+、S2-、Br-、Na+
【解析】亚铁离子是浅绿色的,A错误。加入铝粉能放出H2的溶液可以是酸性溶液,也可以是碱性溶液,碱性溶液中NH4+不能大量共存,C不正确。铜离子和硫离子不能大量共存,且硫离子和铝离子也不能大量共存,所以正确的答案是B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com