
题目列表(包括答案和解析)
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S0425mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是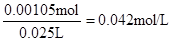 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
(16分) 向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1 阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.

请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
【解析】(1)化学反应速率通常用单位时间内浓度的变化量来表示。根据图像I可知在15min内C的浓度变化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率为
(2)由图像Ⅱ可知,在t4~t5阶段反应速率减小,但平衡不移动,所以改变的条件不可能是温度和浓度,由于在t3~t4阶段为使用催化剂,所以该阶段只是降低压强。这说明改变压强平衡不移动,因此反应前后体积是不变的。根据图像I可知A是反应物,C是生成物,二者的变化量之比是2︰3,所以要使反应前后体积不变,B只是反应物,及反应的方程式为2A+B 3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为
3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为 。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
(3)根据题意科判断,每消耗0.01molA,反应就吸收能量akJ,所以反应的热化学方程式为2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因为容器容积不变(容器容积是2L),所以要使平衡等效,则起始物质的物质的量是相等的。根据题意可知起始时AB的物质的量分别为2.4mol和1.2mol,则把cmol的C转化为AB,则AB的物质的量(mol)分别是a+2c/3、b+c/3,所以关系式必须满足a+2c/3=2.4、b+c/3=1.2.
(16分)向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1 阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1= (保留两位小数),
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
【解析】(1)化学反应速率通常用单位时间内浓度的变化量来表示。根据图像I可知在15min内C的浓度变化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率为
(2)由图像Ⅱ可知,在t4~t5阶段反应速率减小,但平衡不移动,所以改变的条件不可能是温度和浓度,由于在t3~t4阶段为使用催化剂,所以该阶段只是降低压强。这说明改变压强平衡不移动,因此反应前后体积是不变的。根据图像I可知A是反应物,C是生成物,二者的变化量之比是2︰3,所以要使反应前后体积不变,B只是反应物,及反应的方程式为2A+B3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为
![]() 。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
(3)根据题意科判断,每消耗0.01molA,反应就吸收能量akJ,所以反应的热化学方程式为2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因为容器容积不变(容器容积是2L),所以要使平衡等效,则起始物质的物质的量是相等的。根据题意可知起始时AB的物质的量分别为2.4mol和1.2mol,则把cmol的C转化为AB,则AB的物质的量(mol)分别是a+2c/3、b+c/3,所以关系式必须满足a+2c/3=2.4、b+c/3=1.2.
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S04 25mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是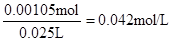 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )
|
A |
|
C |
|
|
B |
|
A、三种元素的原子半径的大小顺序是:B>C>A
B、A元素最高价氧化物对应的水化物具有强氧化性
C、B元素的氧化物、氢化物的水溶液都呈酸性
D、C元素是非金属性最强的元素
【解析】考查元素周期表的结构和元素周期律的应用。因为质子数和中子数之和是质量数,若A的原子序数是x,则B是x+9,C是x+2。根据题意可知x+x+2+x+9=2×(x+9),解得x=7,则A、B、C分别是N、S、F。同主族元素自上而下原子半径逐渐增大,非金属性逐渐减弱,金属性逐渐增强。同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱。A不正确,应该是B>A>C,硝酸是氧化性酸,B正确。硫酸和氢硫酸都属于酸,C正确。F是最强的非金属元素,D正确,所以答案是A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com