
题目列表(包括答案和解析)
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: 室温下,相关金属氢氧化物沉淀的KSP见下表1
|
某溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L).现用碱调节溶液pH,根据表可知,
|
| A、配制FeSO4溶液时,加入一些铁粉 | ||||||||
B、
| ||||||||
C、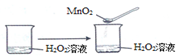 | ||||||||
D、
|
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A、纯水中25°C时的,c(H+)比100℃的时c(H+)大 | B、100℃时某溶液中由水电离产生的c(H+)═1×10-11mol?L-1,则该溶液的Ph可能是11或3 | C、将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | D、25℃时,某Na2SO4溶液中c(SO 42-)=5.0×10-4mol/L则溶液中c(Na+):c(OH-)为104:1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com