
题目列表(包括答案和解析)
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是
(2)现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是
| 净含量:500mL | |
| 饮用水矿物质成分(mg.L-1) | |
| 钙Ca | ≥4.0 |
| 镁Mg | ≥1.0 |
| 钠Na | ≥3.0 |
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是

A B
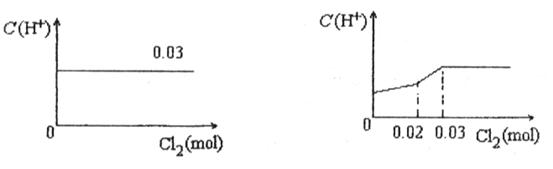
C D
某密闭容器中加入0.3 molA 、0.1 molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0-t1阶段 c ( B)未画出]。图乙为t2后改变互不相同的某一条件反应速率跟时间的关系,已知,t3 - t4阶段使用催化剂。下列说法正确的是
A.若 t1= 15 s,生成物C在 t0-t1时间段的平均反应速率为 0.004mol·L-1·s-1
B.t4 - t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5-t6改变的条件是增大反应物浓度

对于难溶盐MX,其饱和溶液的Mn+和Xn- 离子的物质的量浓度之间的关系近似于水的离子积Kw(Kw = c(OH-) c(H+)),存在着c(Mn+) c(Xn-)=K的关系(K为常数).现将足量的AgCl固体分别放入下列物质中:
①10 mL蒸馏水 ②40mL 0.03mol/L盐酸
③50mL 0.05mol/LAgNO3溶液 ④30mL 0.02mol/LCaCl2溶液
AgCl的溶解度由大到小排列的顺序是
A.①>②>④>③ B. ②>③>④>①
C.①>②>③>④ D. ③>②>④>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com