
题目列表(包括答案和解析)
[化学—物质结构与性质](13分)
(1)元素的第一电离能:Al_Si(填“>”或“<”)。
(2)基态M矿+的核外电子排布式为 。
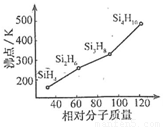
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示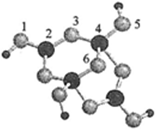
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
[化学—物质结构与性质](13分)
(1)元素的第一电离能:Al_Si(填“>”或“<”)。
(2)基态M矿+的核外电子排布式为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示
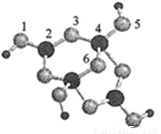
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
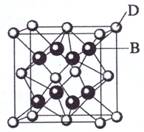
(10分)已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(1)A与B形成的化合物在固态时的晶体类型是 ;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(2)写出C的单质与水反应的离子方程式 ;
(3)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
【解析】在前36号元素中,符合周期表中1—18列中的第8列元素的是铁,即E是铁,则D是Ca。根据D跟B形成离子化合物晶胞结构可判断,该离子化合物是DB2,则B是F或Cl。因为B和C属同一主族,且原子序数前者小于后者,所以B只能是F,C是Cl,A与其他4种元素既不在同一周期又不在同一族,所以A是H。
(1)HF属于分子晶体,由于HF中含有氢键,所以HF的沸点高于氯化氢的。
(2)氯气溶于水生成盐酸和次氯酸。
(3)鉴别离子化合物是否为晶体,最可靠的科学方法是射线衍射法。在该晶胞中含有的该离子是8×1/8+6×1/2=4,则F-是8,所以晶胞的体积是(8b+4c)/a NA。
(10分)已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
 (1)A与B形成的化合物在固态时的晶体类型是
;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(1)A与B形成的化合物在固态时的晶体类型是
;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(2) 写出C的单质与水反应的离子方程式
;
写出C的单质与水反应的离子方程式
;
(3)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
【解析】在前36号元素中,符合周期表中1—18列中的第8列元素的是铁,即E是铁,则D是Ca。根据D跟B形成离子化合物晶胞结构可判断,该离子化合物是DB2,则B是F或Cl。因为B和C属同一主族,且原子序数前者小于后者,所以B只能是F,C是Cl,A与其他4种元素既不在同一周期又不在同一族,所以A是H。
(1)HF属于分子晶体,由于HF中含有氢键,所以HF的沸点高于氯化氢的。
(2)氯气溶于水生成盐酸和次氯酸。
(3)鉴别离子化合物是否为晶体,最可靠的科学方法是射线衍射法。在该晶胞中含有的该离子是8×1/8+6×1/2=4,则F-是8,所以晶胞的体积是(8b+4c)/a NA。
(8分)有下列八种晶体:
| A.(水晶)SiO2 | B.冰醋酸 | C.氧化镁 | D.白磷 E.固体氩 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com