
题目列表(包括答案和解析)
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列 (填这些物质的序号),其中CA3 、GA3在常温、常压下都是气体,但CA3 比GA3 易液化,其主要原因是 。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨反应的催化剂)的表面上存在C原子,右图为C原子在L的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C原子数之比为 。

(4)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。

(5)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。

请回答:晶胞中M原子的堆积方式为 ,配位数为 。
(12分)(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
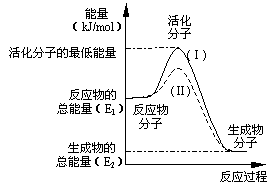 ①图中所示反应是_____________(填“吸热”
①图中所示反应是_____________(填“吸热”
或“放热”)反应,该反应____________
(填“需要”或“不需要”)加热,该反应的
△H=____________(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);
△H=-241.8 kJ/mol。该反应的活化能为
167.2kJ/mol,则其逆反应的活化能为____________。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,
活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是_________ ____________________________________________。
(2)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
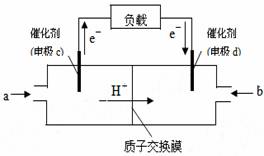 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
甲醇在催化剂作用下提供质子和电子,电子经外电路、
质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2=2CO2+4H2O。则c电极是
(填“正极”或“负极”),c电极上发生的电极反应式
是 。
(11分)常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道类型为 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
元素Y第一电离能大于X的原因是 ;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。
①写出铁元素基态原子价电子的轨道表示式 ;
②已知CN- 与 N2 结构相似,1 mol CN-中 键数目为 ;
键数目为 ;
【解析】(1)NaCl、MgCl2等均是由离子键形成的离子化合物,因此形成的晶体是离子晶体。
(2)水和硫化氢虽然都是分子晶体,但水分子中存在氢键,所以其熔点高于硫化氢的。水分子中的中心原子有4对电子对,其中2对是孤电子对,所以杂化轨道类型是sp3。
(3)气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫第一电离能。根据表中数据可判断X、Y、Z分别是Al、Mg、Na。由于Al是3p1,而Mg为3s2构型,此时3p0全空,特别稳定。
(4)①元素原子的最外层电子是价电子,对于副族和第Ⅷ元素其次外层或倒数第三层电子也可以成为价电子。铁属于第Ⅷ元素,其价电子轨道表达式是
②氮气中氮原子和氮原子形成的化学键是氮氮三键,而三键是由2个![]() 键和1个
键和1个![]() 键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中
键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中![]() 键数目为2NA。
键数目为2NA。
(11分)常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道类型为 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
X |
578 |
1817 |
2745 |
11578 |
|
Y |
738 |
1451 |
7733 |
10540 |
|
Z |
496 |
4562 |
6912 |
9543 |
元素Y第一电离能大于X的原因是 ;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。

①写出铁元素基态原子价电子的轨道表示式 ;
②已知CN- 与 N2 结构相似,1 mol CN-
中 键数目为
;
键数目为
;
【解析】(1)NaCl、MgCl2等均是由离子键形成的离子化合物,因此形成的晶体是离子晶体。
(2)水和硫化氢虽然都是分子晶体,但水分子中存在氢键,所以其熔点高于硫化氢的。水分子中的中心原子有4对电子对,其中2对是孤电子对,所以杂化轨道类型是sp3。
(3)气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫第一电离能。根据表中数据可判断X、Y、Z分别是Al、Mg、Na。由于Al是3p1,而Mg为3s2构型,此时3p0全空,特别稳定。
(4)①元素原子的最外层电子是价电子,对于副族和第Ⅷ元素其次外层或倒数第三层电子也可以成为价电子。铁属于第Ⅷ元素,其价电子轨道表达式是
②氮气中氮原子和氮原子形成的化学键是氮氮三键,而三键是由2个 键和1个
键和1个 键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中
键组成的。CN- 与 N2 结构相似,所以1 mol CN- 中 键数目为2NA。
键数目为2NA。
材料一:向可溶性铝盐溶液中加入氨水,会生成白色的胶状氢氧化铝沉淀,该沉淀既可溶于强酸之中,又可溶于强碱之中,因此是一种两性氢氧化物。有人认为,氢氧化铝之所以具有两性,原因是在水中存在下列酸式电离和碱式电离的有关平衡:
H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。
Al3++3OH-。
材料二:在共价键中有一种价键与一般的形成方式不同,即一方(设为A方)提供两个电子,另一方(设为B方)具有接受两个电子的空轨道,从而形成如下一种特殊化学键:A→B。这样的共价键叫做配位键。如![]() 和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即
和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即

同共价键一样,配位键可以存在于分子之中(如H2SO4、AlCl3等),也可以存在于离子之中(如![]() )。
)。

材料三:已知气态氯化铝分子以双聚形式存在,其中Al-Cl键为共价键,其结构式如上图中间结构所示。图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。
(1)通过对有关信息的学习,你对于硼酸只是一元酸是怎样认识的?
你可以通过硼酸在水溶液中的电离平衡,来解释它只是一元酸的原因。请写出下面方程式右端的两种离子的表达式:

(2)你对于材料一中氢氧化铝的有关电离方程式是怎样认识的?你完全认可吗?如果不认可,请你写出你认为的铝酸的电离方程式:________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com