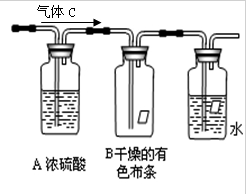
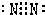(2013?通州区二模)四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)B元素在周期表中的位置
第2周期ⅣA族
第2周期ⅣA族
;
(2)BC
2分子的电子式
;
(3)A元素的单质与物质甲发生反应的离子方程式
Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
;
(4)丙的钠盐溶液呈
碱
碱
性,用化学用语表示其原因
Cl-+H2O?HClO+OH-
Cl-+H2O?HClO+OH-
;
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:
①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀.向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字.
①
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)
;
②
2H2O2=2H2O+O2↑
2H2O2=2H2O+O2↑
;
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈
;
③
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.
反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++3H2O?Fe(OH)3+3H+,正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁)
.