
题目列表(包括答案和解析)
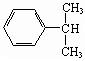
下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
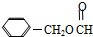 )是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题:
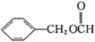
)是一种重要的工业使用的有机溶剂.分析如图的框图关系,然后回答问题: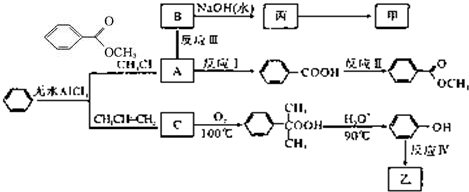
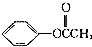

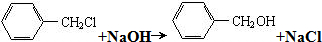
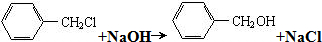
| 元素 | Mn | Fe | |
| 电离能( kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(8分)已知由短周期元素组成的A、B、C、D四种常见化合物分子中所含原子数目依次为2、3、4、5,其中A、B含有18个电子,C、D含有10个电子。请回答:
(1)D中含有的化学键类型有 ,已知8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式 。
(2)室温下,若向一定量C的稀溶液中逐滴加入物质的量浓度相同的A,直至A过量,生成化合物XY4Z(X、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
|
|
离子浓度由大到小的顺序 |
溶质的化学式 |
溶液的pH |
|
I |
c(XY+4)>c(Z—)>c(OH—)>c(H+) |
|
pH>7 |
|
II |
c(XY+4)=c(Z—) |
XY4Z、XY3·H2O |
|
|
III |
|
XY4Z |
pH<7 |
|
IV |
c(Z—)>c(H+)>c(XY+4)> >c(OH—) |
|
pH<7 |
(3)B在空气中完全燃烧生成E,在一定条件下发生E与O2反应生成F。
①将0.05molE和0.03molO2放入容积为1L的密闭容器中,达到平衡,测得c(F)=0.04mol·L—1。计算该条件下反应的平衡常数K= 和E的平衡转化率 。
②已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高E平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有 个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是 。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com