
题目列表(包括答案和解析)
| SO | 2- 4 |
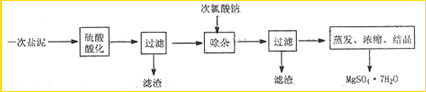
MgSO4•7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
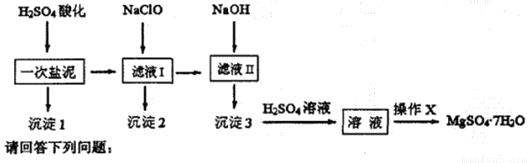
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4•7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol•L—1的盐酸5mL,在不断搅拌下滴加足量2 mol•L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
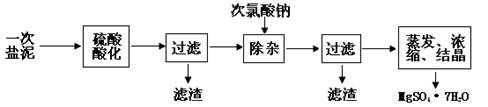
(1)用硫酸调整溶液pH到1~2,硫酸的作用是 。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是 。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是 。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→ 。
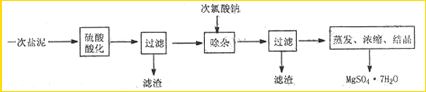
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO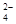 )=
。
)=
。
MgSO4?7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4?7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol?L—1的盐酸5mL,在不断搅拌下滴加足量2 mol?L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
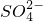 )=______.
)=______.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com