
题目列表(包括答案和解析)
| A.常温下,0.0025mol/LNaOH溶液 pH=11.4 |
| B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小 |
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示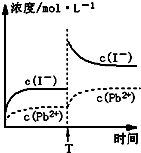 |
| D.本次实验测得的t℃PbI2的Ksp=4×10-9 |


铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com