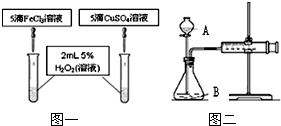
实验室常用下列装置制取有关气体.
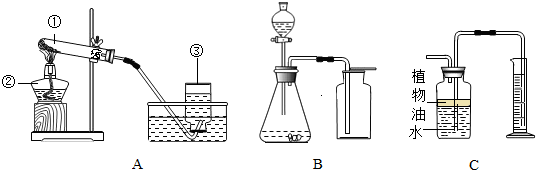
(1)用A装置来KMnO
4固体制取O
2,该发生装置还可以做我们学过的铜绿分解实验,写出这个反应的化学方程式:
(2)C装置可用来测量生成的CO
2气体的体积,其中在水面上放一层植物油的目的是
防止二氧化碳和水反应
防止二氧化碳和水反应
,植物油上方原有的空气对实验的结果
没有
没有
(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
.
(4)实验室里还可采用B图装置,通过用MnO
2作催化剂分解过氧化氢(H
20
2)的方法制取氧气.写出该反应的化学方程式:
(5)某研究小组对用H
2O
2分解生成H
2O和O
2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H
2O
2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H
2O
2溶液的试管中,加入a克MnO
2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H
2O
2溶液的试管中,加入a克Fe
2O
3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO
2和a克Fe
2O
3.
问题:(1)MnO
2和Fe
2O
3是上述反应中的
催化
催化
剂.
(2)实验②,③中的H
2O
2的浓度(ω%)以
5%
5%
为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H
2O
2溶液制取相同体积O
2所需的时间
浓度 时间(min)
条件 |
30%H2O2溶液 |
15%H2O2溶液 |
5%H2O2溶液 |
| a克MnO2 |
0.2 |
0.8 |
2.0 |
| a克Fe2O3 |
7.0 |
9.0 |
16.0 |
问题:(3)从上表中能得出哪些结论?
相同条件下,MnO2的催化效果比Fe2O3好
相同条件下,MnO2的催化效果比Fe2O3好
、
在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
(至少写两点)
(6)[提出问题]小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
[猜想]水泥块能作过氧化氢分解的催化剂.
[实验验证]
|
实验步骤 |
实验现象 |
实验结论 |
| 实验一 |
往盛有过氧化氢溶液的试管中,伸入带火星的木条 往盛有过氧化氢溶液的试管中,伸入带火星的木条 |
木条不复燃 |
常温下过氧化氢溶液不分解 |
| 实验二 |
在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 |
木条复燃 |
过氧化氢溶液在水泥块的作用下能够分解产生氧气 过氧化氢溶液在水泥块的作用下能够分解产生氧气 |
[结论]水泥块能加快过氧化氢的分解速率,故水泥起能作过氧化氢的催化剂.
[讨论与反思]小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究
水泥块的质量在反应前后是否改变
水泥块的质量在反应前后是否改变
.
[实验步骤]①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,
干燥
干燥
,
准确称量水泥块的质量
准确称量水泥块的质量
④对比反应前后水泥块的质量.
[分析]如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究
水泥块的化学性质是否改变
水泥块的化学性质是否改变
.

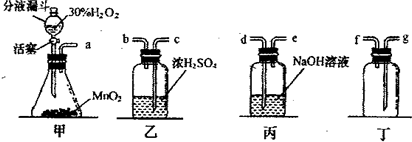
 过氧化氢(H2O2)溶液在Mn02作催化剂的条件下,能迅速发生分解.分液漏斗可以通过调节活塞控制液体的滴加速率.现欲制取干燥且纯净的氧气,采用如图所示的装置.回答下列问题:
过氧化氢(H2O2)溶液在Mn02作催化剂的条件下,能迅速发生分解.分液漏斗可以通过调节活塞控制液体的滴加速率.现欲制取干燥且纯净的氧气,采用如图所示的装置.回答下列问题: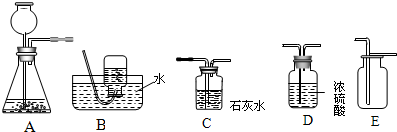

 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.