
题目列表(包括答案和解析)
(本小题共12分)
已知椭圆 .过点(m,0)作圆
.过点(m,0)作圆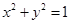 的切线L交椭圆G于A,B两点.
的切线L交椭圆G于A,B两点.
(I)求椭圆G的焦点坐标和离心率;
(II)将 表示为m的函数,并求
表示为m的函数,并求 的最大值.
的最大值.
(本小题共12分) 已知函数 的部分图象
如图所示,求f(x)的解析式.
的部分图象
如图所示,求f(x)的解析式.

(本小题共12分)已知函数![]() 。
。
(Ⅰ)求![]() 的最小正周期;
的最小正周期;
(Ⅱ)求![]() 在区间
在区间![]() 上的最大值和最小值。
上的最大值和最小值。
(本小题共12分) 已知两圆 ,
,
求(1)它们的公共弦所在直线的方程;(2)公共弦长。
(本小题共12分)
已知双曲线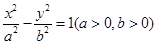 过点A(2,3),其一条渐近线的方程为
过点A(2,3),其一条渐近线的方程为

(I)求该双曲线的方程;
(II)若过点A的直线与双曲线右支交于另一点B, 的面积为
的面积为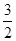 ,其中O为坐标原点,求直线AB的方程。
,其中O为坐标原点,求直线AB的方程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com