
题目列表(包括答案和解析)
(10分)工业上以锂辉石(,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①
②某些物质的溶解度()如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(10分)工业上以锂辉石(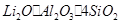 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:

已知:①
②某些物质的溶解度(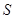 )如下表所示。
)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出A12O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
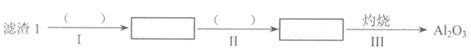
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
|
实验 编号 |
KClO3 (g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
||||
|
1 |
0.6 |
— |
— |
— |
10 |
480 |
|
2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.6 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用 检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
| 实验 编号 | KClO3 (g) | 氧化物 | 产生气体(mL) (已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用 检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
10 ℃时各物质的溶解度
NaNO3 | NaCl | KNO3 | KCl |
80 g | 35.8 g | 20.9 g | 31 g |
A.混合溶液中无任何晶体析出
B.混合溶液中有KNO3、NaCl两种晶体同时析出
C.混合溶液中只有NaCl晶体析出
D.混合溶液中只有KNO3晶体析出
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
D
A
B
C
D
B
C
B
D
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
AC
AD
AB
C
D
C
AD
B
C
三.(本题包括3小题,,共34分)
19.(14分)
(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (其他合理的试剂也可给分)
(3)NaOH , C (2分,各1分)
(4)除去NaOH和Na2CO3(2分)
(5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 , 5.61×10―8 mol?L―1。(2分,各1分) ]
20.(7分)
(1)掩蔽Fe3+,防止造成偏大的误差(1分)
(2)提供酸性条件,抑制Cu2+的水解(1分)
(3)防止空气中的氧气与碘化钾反应(1分)
(4)2Cu2++4I-=2CuI↓+I2 (2分)
(5)ω(Cu)= 64CV/
21.(13分) (1分)
⑴(2分)测定pH 或滴加Na2CO3溶液 或将甲酸滴加到滴有酚酞的NaOH溶液中(不能用Na,其它合理答案均可得分)
⑵(2分)测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等(合理均可给分)
⑶(2分)出现银镜,由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质(1分。羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型);或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性(1分)
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O(2分)
 ②(4分)
②(4分)
四.(本题包括3小题,共34分)
22.(9分)(每空各1分)
(1)氮气 ,氮化硅(化学式同样给分)
(2)K=[c(CO)]6/[c(N2)]2
(3)< , 减小,6 mol•L-1.min‑1
(4)升高温度或增大压强 , t3∽t4
(5)50% (3分)
23.(11分)
(1)D (1分)
(2)Cu (1分)
(3)H2 (1分) ;①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大;②该反应放热,升高温度反应加快; ③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分) (1分)
24.(12分)
|