
题目列表(包括答案和解析)
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)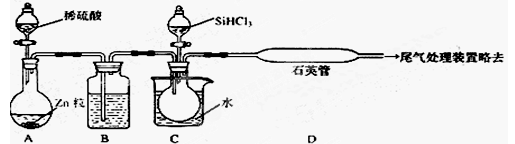
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3 在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
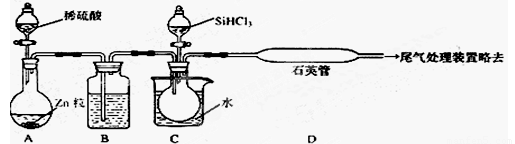
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
|
装置 |
实验序号 |
试管中的药品 |
现象 |
|
|
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
|
实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O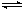 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为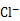 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com