
题目列表(包括答案和解析)
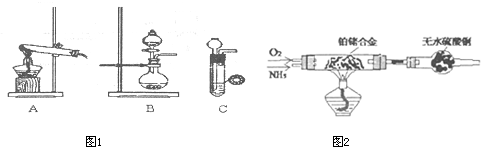
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
| ||
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
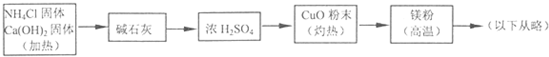
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。

氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。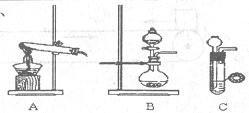
(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |

 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由 。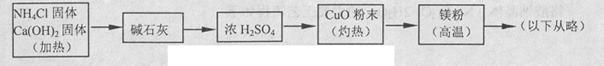
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com