
题目列表(包括答案和解析)
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上____________(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为___________,正极的电极反应式为___________.
(2)如果烧杯中最初装入的是2mol/L500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________.
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),电化学腐蚀中又分为吸氧腐蚀和析氢腐蚀.如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,主要发生___________电化学腐蚀,写出正极的电极反应式一.

(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是___________.
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上____________(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为___________,正极的电极反应式为___________.
(2)如果烧杯中最初装入的是2mol/L500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________.
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),电化学腐蚀中又分为吸氧腐蚀和析氢腐蚀.如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,主要发生___________电化学腐蚀,写出正极的电极反应式一.

(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是___________.
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上________
(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为______,正极的电极反应式为___________。
(2)如果烧杯中最初装入的是500mL 2 mol·L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)________________________。
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
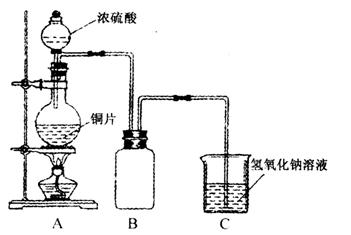
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com