
题目列表(包括答案和解析)

(10分)温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
A.制备环氧乙烷:
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 _____________________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 ____________________________________________________________。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
|
|
乙烯 |
来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
(10分)温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________ 。
![]() A.制备环氧乙烷:
A.制备环氧乙烷:
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 __________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 ________________________。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 |
|
| 乙烯 | 来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
| |||||||||||||||||||||||
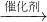

 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O 2CH3OH
2CH3OH| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3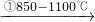 CaO CaO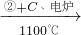 CaC2 CaC2 C2H2 C2H2 |
| 乙烯 | 来源于石油裂解气 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com