
题目列表(包括答案和解析)
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________________。
(2)由于ZnCl2溶液蒸干灼烧后,得不到无水ZnCl2固体,只能得到ZnCl2水解的产物Zn(OH)Cl。所以,工业上往往用ZnCl2的水合晶体ZnCl2·xH2O和SOCl2混合共热来制取无水ZnCl2。在这种制法中SOCl2与晶体中结晶水反应的生成物使ZnCl2的水解被抑制,故可得无水ZnCl2。试解释灼烧过程中SOCl2抑制ZnCl2水解的原因:____________________
_________________________。
(3)SOCl2还能和某些含羟基的有机物反应,如它与乙醇的反应可表示为:
C2H5OH+SOCl2![]() C2H5Cl+SO2+HCl
C2H5Cl+SO2+HCl
和该反应相似,当过量的SOCl2跟苯甲酸混合,稍加热即发生反应,苯甲酸完全转化成一种沸点为197 ℃的液态有机物。该反应的化学方程式可表示为:_______________________。
为了使生成的有机物与混溶于其中的SOCl2分离,可以使用下列中______方法。
A.过滤 B.分液 C.蒸发结晶 D.蒸馏
| a |
| 200b |
| a |
| 200b |
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |




(10分)生产氯化锌的主要原料有锌渣等,这些物料含锌30%-70%(其中含有少量的Fe、Cu等硫酸盐),生产工艺流程如图所示(第一次净化含调节pH的过程)。www.ks5.u.com
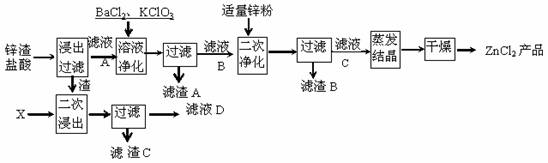
(1)二次浸出时加入的X的化学式是______________,滤液D应该和滤液A、B、C中的滤液 合并。
(2)第一次净化时加入BaCl2的作用是 。
(3)二次净化后过滤得到的滤渣B的主要成分是 。
(4)请用离子方程式表示加入氯酸钾的作用 。
(5)已知SOCl2是液态化合物,沸点是77℃,在盛有10mL水的锥形瓶中小心滴加几滴SOCl2,可观察到反应剧烈,液面上有白雾形成,并逸出刺激性气味的气体。工业上常用ZnCl2?3H2O和SOCl2混合共热来制取无水氯化锌,这种制法可行性的原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com