
题目列表(包括答案和解析)
已知:表I是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
表I

表Ⅱ是一些气态基态原子的第一、二、三、四级电离能(kJ?mol-1):
表Ⅱ
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
请根据上述信息,回答下列问题:
(1)为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_____。
(2)表中Y可能为以上13种元素中的_____ (填写字母)元素。用元素符号表示 X和j形成的化学键种类最多的一种化合物的化学式_____。
(3)根据构造原理,用电子排布式表示e的特征电子构型_____。
(4)以上13种元素中,_____ (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)i元素另一元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属_____晶体,若使其熔化,需破坏的作用力为_____。


阅读下面一段文字,回答有关问题:
中国科学院近代物理研究所利用重离子加速器提供的丰中子束氧-18轰击天然铀靶,使用奇异的多核子转移反应,在“可裂变核区”合成了重质量丰中子新核素镤-239,这在世界上尚属首次。镤-239是中科院近代物理研究所在质量数大于170的重质量丰中子区合成的第四个新核素。这一成果填补了核素图上又一个空白,为重质量丰中子区的核结构和天文物理研究提供了很有价值的信息。
(1)氧-18原子中质子数是 ,中子数是 ,核外电子数是 ,有 个电子层,最外层有 个电子,最常见化合价为 。
(2)0.2mol氧-18原子的质量是 。
(3)铀元素有 种核素,其中 是制造原子弹的原料。
(4)在“镤-239是中科院近代物理研究所在质量数大于170的重质量丰中子区合成的第四个新核素”这句话中,质量数的含义是 ,核素的含义是 。
(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33°C)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
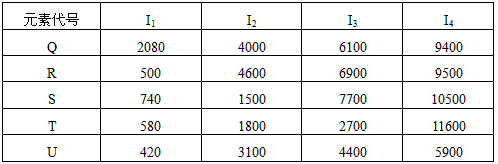
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族。
若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com