
题目列表(包括答案和解析)
| 元素 | Mn | Fe | |
| 电离能( kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
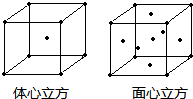


| 水 |
| 水 |

 +CH3CH2Cl
+CH3CH2Cl +HCl
+HCl +CH3CH2Cl
+CH3CH2Cl +HCl
+HCl

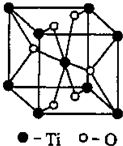 [化学-物质结构与性质]
[化学-物质结构与性质] 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com