
题目列表(包括答案和解析)

| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
| ||
| ||
| ||
| ||
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
在学习了铜元素的性质之后,小明同学做了H2O2与铜的有关探究实验:
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是 。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式: 。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为 。
小明同学设计了以废铜屑制取硫酸铜的三个方案:
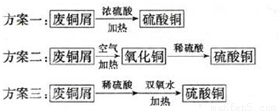
①认为最佳方案是 。
②简述另两个方案的不足之处: 。
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
评分说明:
1.考生如按其他方法或步骤解答,正确的,同样给分;有错的根据错误的性质,参照评分参考中的规定评分。
2.计算题只有最后答案而无演算过程,不给分,只写出一般公式但未能与试题所给的具体条件联系的,不给分。
Ⅰ卷包括21题,每小题6分,共126分。
一、选择题:
1.C 2.D 3.B 4.D 5.D 6.D 7.C 8.B 9.B 10.C 11.A 12.D
二、选择题:
13.CD 14.C 15.A 16.D 17.BD 18.C
Ⅱ卷包括10题,共174分。
19.(18分)
(1)2.37(3分); 6.574( 0.002)(3分)
0.002)(3分)
(2)①×100(2分); 1.4×10 (2分)
(2分)
②闭合关闭 (2分);
(2分);  (2分)
(2分)
③不合理(2分);因为电留表的读数几乎为零,不便测量。(2分)
20.(15)【解析】
(1)根据匀变速直线运动规律有 (2分)
(2分)
 (2分)
(2分)
解得 (1分)
(1分)
 (1分)
(1分)
(2)由图像可知时间 内运动员做初速为零的匀加速直线运动
内运动员做初速为零的匀加速直线运动
位移大小  (2分)
(2分)
时间 内运动员以速度
内运动员以速度 做匀速直线运动
做匀速直线运动
位移大小  (2分)
(2分)
在 内的位移大小
内的位移大小 (2分)
(2分)
在 内的平均速度
内的平均速度 (2分)
(2分)
解得  (1分)
(1分)
(利用数方格个数近似算出 内的位移大小,再求出平均速度大小的也可以酌情给分)
内的位移大小,再求出平均速度大小的也可以酌情给分)
21.(19分)【解析】
(1)小球从A→C,由机械能守横定律得 (2分)
(2分)
小球在C点处,根据牛顿第二定律有 (2分)
(2分)
解得 (2分)
(2分)
小球到达C点时对管壁压力的大小为4.6N,方向竖直向下 (2分)
(2)小球从A→D,由机械能守恒定律得 (2分)
(2分)
代入数值解得 (1分)
(1分)
小球由D点竖直上抛至刚穿过圆筒时,由位移公式得
 (2分)
(2分)
解得 (2分)
(2分)
小球能向上穿出圆筒所用时间满 (2分)
(2分)
联立解得 (2分)
(2分)
22.(20分)【解析】
(1)离子在磁场中仅受洛伦兹力作用做匀速圆周运动,根据牛顿第二定律和向心力公式得
 (2分)
(2分)
 (1分)
(1分)
又
解得 (2分)
(2分)
(2)只要离子沿平行于 方向射出时打不到屏上,则所有离子都打不到平光屏,故离子做匀速圆周运动的半径
方向射出时打不到屏上,则所有离子都打不到平光屏,故离子做匀速圆周运动的半径 (2分)
(2分)
由
得 (1分)
(1分)
故 的取值范围为
的取值范围为 (2分)
(2分)
 (3)若
(3)若 ,则离子做匀速圆周运动的半径
,则离子做匀速圆周运动的半径 (1分)
(1分)
如图所示,离子能打到荧光屏的范围为 ,有几何关系可得
,有几何关系可得
 (2分)
(2分)
 (2分)
(2分)
打到 点的离子离开
点的离子离开 时的初速度方向和打到
时的初速度方向和打到 点的
点的
离子离开 时的初速度方向之间的夹角
时的初速度方向之间的夹角 (2分)
(2分)
故能打到荧光屏 的离子数目与发射的离子总数之比为
的离子数目与发射的离子总数之比为 (2分)
(2分)
即 (1分)
(1分)
23.(14分)
(一)(1)共价键 (2分)
(2) (3分)
(3分)
(3) (3分)
(3分)
(二)(1) (2分)
(2分)
(2)2mol (2分)
(3)大于 (2分)
24.(16分)
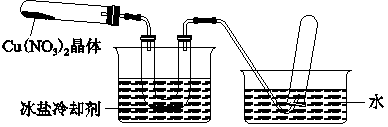
(一)(1)生成等物质的量的硝酸铜,消耗硝酸原料多,且产生污染物氮氧化物.(2分)
(2)坩埚;蒸发浓缩、冷却结晶 (各1分,共3分)
(二)(1) (1分)
(1分)
(2)先把导气管移出水面,然后熄灭火焰 (2分)
(3) (1分)
(1分)
(三)(1) (2分)
(2分)
(2)不能; (1分)
若 溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素;
溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素;
若 溶液不褪色或变浅,则说明产物中不计含+2价铁元素 (2分)
溶液不褪色或变浅,则说明产物中不计含+2价铁元素 (2分)
另取少量溶液,滴加KSCN溶液。 (2分)
25.(15分)
(1)285.8 (3分)
(2) ?moL
?moL (3分)
(3分)
(3)83.3%,减少;逆 (各2分,共6分)
(4) (3分)
(3分)
26.(25分)
Ⅰ(15分)
(1) 叶圆片上浮数
(各2分,共4分)
叶圆片上浮数
(各2分,共4分)
(2)在一定范围内,植物光合速率随 浓度升高而升高
(2分)
浓度升高而升高
(2分)
(3)能 (1分) 叶圆片能光合作用产生 供有氧呼吸利用(2分)(共3分)
供有氧呼吸利用(2分)(共3分)
(4)光照强度弱,光合速率低,产生的 不足
(2分)
不足
(2分)
(5)①等量(或适量等量) ②有一定的合理差距(或不等) (各2分,共4分)
Ⅱ(10分)
(1)神经 (2分)
(2)下丘脑和垂体 神经提体液 (各2分,共4分)
(3)①丙狗剪断支配肾上腺髓质的神经 (2分)
②丁狗结扎通向肾上腺的门脉系统(或丙、丁处理方法对调) (2分)
27.(15)
(1)支持(2分) 控制眼色的基因只位于X染色体上(3分) (共5分)
(2)①因为控制眼色的基因无论位于常染色体或只位于X染色体上。测交实验结果皆相同 (4分)
② (2分)
(2分) 
 (1分)
(1分)  (1分)
(1分)
选考卷
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学体题,
考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题
计分,若第30、31题都作打,则按第30题计分;第32题为生物题,是必答题。请将答案
填写在答题卷选答区域的指定位置上
28.(12分)
(1)①
(2)④
29.(12分)
(1)③
(2)①
30.(13分)
(1) (2分)
(2分)
(2)三角锥形 (2分)
(3)水分子间除分子间作用力外还形成了氢键,而 分子中只有分子间作用(2分)
分子中只有分子间作用(2分)
(4)离子 (2分)
(5)非极性分子;(2分) 3;2;大于 (各1分,共3分)
31.(13分)
(一)丁二酸或丁二醇 (2分)
(二)
(1) ;
(2分)
;
(2分)
(2)D (2分)
(3)3 (2分)
(4)取代; (2分)
 (3分)
(3分)
32.(10分)
(1)限制性核酸内切酶(或限制酶) DNA连接酶 (各2分,共4分)
(2)农杆菌转化法(或基因枪法、花粉管道法) (3分)
(3)DNA分子杂交(DNA分子探针、基因探针) (3分)
(其他合理答案,皆可酌情给分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com