
题目列表(包括答案和解析)
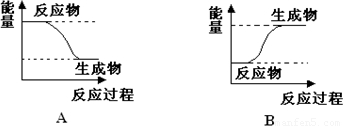
 某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
海水占地球总储水量的97.2%,若把海水淡化和加工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐________t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为HOCH2SO3Na,根据其结构特点,“吊白块”不能发生的反应有________(填字母)。
A.皂化反应 B.聚合反应
C.与金属钠反应 D.氧化反应
| |||||||||||||||||||||||||||||||
水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。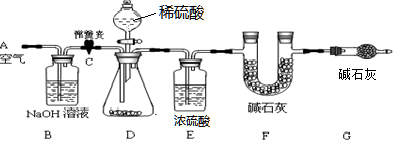
【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com