
题目列表(包括答案和解析)
实验室制备肉桂酸的化学方程式为:

副反应: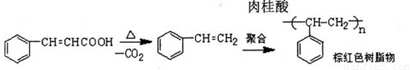
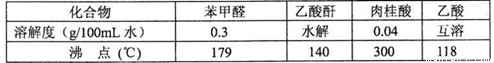
药品物理常数
主要实验装置和步骤如下:
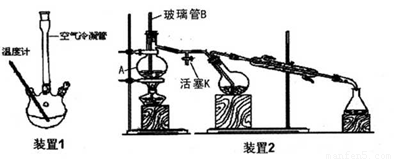
(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A. 使肉桂酸蒸出影响产率
B. 使乙酸酐蒸出影响产率
C. 肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D. 反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
实验室制备肉桂酸的化学方程式为:
副反应:
药品物理常数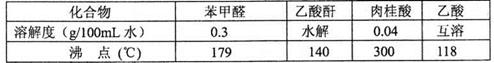
主要实验装置和步骤如下:
(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A.使肉桂酸蒸出影响产率
B.使乙酸酐蒸出影响产率
C.肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D.反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
(16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
① 灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是 。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3-等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 |
|
| 步骤3:
|
|
(16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
① 灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是 。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 | |
| 步骤3: | |
(16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
① 灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是 。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
|
实验操作 |
预期现象与结论 |
|
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 |
若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
|
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 |
|
|
步骤3:
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com