
题目列表(包括答案和解析)
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,
4NH3(g)+5O2 4NO(g)+6H2O(g); △H=-905 kJ/mol……①
4NO(g)+6H2O(g); △H=-905 kJ/mol……①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,
2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,
下列说法正确的是
| A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率 |
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) 2NO(g) |
(09盐城第三次调研)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②
![]() 4NH3(g) +5O2
4NH3(g) +5O2![]() 4NO(g)+6H2O(g);△H=-905kJ/mol………………①
4NO(g)+6H2O(g);△H=-905kJ/mol………………①
![]() 4NH3(g) + 3O2(g)
4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g);△H=-1268kJ/mol………②;
2N2(g) + 6H2O(g);△H=-1268kJ/mol………②;
![]()
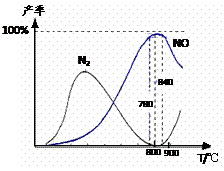 下列说法正确的是
下列说法正确的是
![]() A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间
A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间
![]() B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
![]() C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D.氮气氧化为NO的热化学方程式为:N2(g)+ O2(g) ![]() 2NO(g);
2NO(g);
△H=+181.5 kJ/mol
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2![]() 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(10分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O24NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
(10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的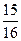 ,则N2的转化率
,则N2的转化率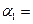 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为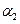 ,则
,则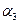
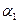 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com