
题目列表(包括答案和解析)
蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2—NH2+H2SO4+2H+ ________。
________。
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的盐酸标准溶液滴定,根据盐酸的消耗量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为________。
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿患肾结石。
①三聚氰胺的结构如图所示,其化学式为________,含氮量(氮元素的质量分数)为________;
②下列关于三聚氰胺的说法中,正确的有________
A.三聚氰胺是一种白色结晶粉末,没有什么气味和味道,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③假定奶粉中蛋白质的含量为16%即为合格,不法分子在一罐总质量为500 g、蛋白质含量为0的假奶粉中掺入多少克的三聚氰胺就可使奶粉“达标”?
(1)氨基酸是蛋白质的基石,氨基酸分子中的氨基(―NH2)显碱性。氨基酸往往形成一种两性离子,在水溶液中存在如下平衡:
![]()
 。
。
方框内所表示的离子(Ⅰ)的结构简式是 。
![]() (2)谷氨酸的一钠盐(
(2)谷氨酸的一钠盐( )是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
)是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
实验室中检验淀粉水解产物应选用的试剂是 (填字母)。
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛滴定法”用于测定味精中谷氨酸一钠盐的含量。将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为 ―NH2 + HCHO → ―N=CH2 + H2O,再以酚酞为指示剂,用NaOH溶液进行滴定。上述测定过程中加入甲醛的目的是 。
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、 (填缺少的步骤),称量沉淀质量,重复实验3次。
②乙方案:已知AgSCN是难溶于水的沉淀。取m g味精溶于水,加入过量浓度为c1 mol?L-1的AgNO3溶液,再加入少量 (填可能的化学式)溶液作指示剂,用浓度为c2 mol?L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1 mL和V2 mL,则该味精样品中NaCl的质量分数是?
 )中,既有碱性的氨基(―NH2)、又有酸性的羧基(―COOH)。在一定的酸、碱性条件下,能自身成盐(
)中,既有碱性的氨基(―NH2)、又有酸性的羧基(―COOH)。在一定的酸、碱性条件下,能自身成盐( )。所以在氨基酸分析中不能用碱溶液测定氨基酸中羧基的数目,而应先加入甲醛,使它与
)。所以在氨基酸分析中不能用碱溶液测定氨基酸中羧基的数目,而应先加入甲醛,使它与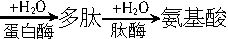 (1)化合物A的分子式为C8H15O4N3。中和1molA与甲醛反应后的产物消耗1molNaOH。1molA与HNO2反应放出1molN2 并生成B(C8H14O5N2)。B经水解后得羟基乙酸和丙氨酸。则:①A的结构简式为_______;②B的结构简式为______;③A跟甲醛反应的化学方程式为_______。
(1)化合物A的分子式为C8H15O4N3。中和1molA与甲醛反应后的产物消耗1molNaOH。1molA与HNO2反应放出1molN2 并生成B(C8H14O5N2)。B经水解后得羟基乙酸和丙氨酸。则:①A的结构简式为_______;②B的结构简式为______;③A跟甲醛反应的化学方程式为_______。L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
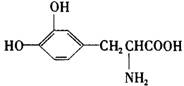
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。下列关于L-多巴酸碱性的叙述正确的是
A.在由该氨基酸参与形成的蛋白质中滴加浓硝酸、加热,能够产生黄色沉淀
B.既具有酸性,又具有碱性
C.只有酸性,没有碱性
D.只有碱性,没有酸性
(化学-物质结构与性质)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com