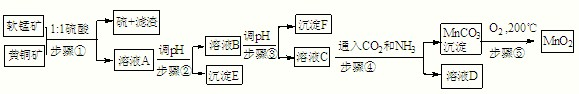
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al
2O
3)
NaOH溶液
NaOH溶液
(2)Cl
2(HCl)
饱和NaCl溶液
饱和NaCl溶液
(3)FeCl
3(FeCl
2)
氯气或氯水
氯气或氯水
(4)NaHCO
3溶液(Na
2CO
3)
CO2
CO2
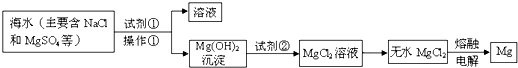
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:
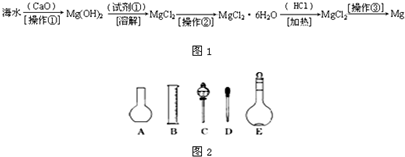
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
;
操作①主要是指
过滤
过滤
;试剂①可选用
HCl
HCl
;操作②是指
蒸发浓缩,冷却结晶,过滤
蒸发浓缩,冷却结晶,过滤
;经操作③最终可得金属镁.
(三)实验室配制480ml 0.1mol?L
-1的Na
2CO
3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
14.3
14.3
g.
(2)如图2所示的仪器配制溶液肯定不需要的是
AC
AC
(填序号),本实验所需玻璃仪器E规格为
500
500
mL.
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
①③⑤
①③⑤
.(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
dbac
dbac
.(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
2
2
种用途.(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是
CE
CE
.
A.配制前设有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈; E.定容时仰视刻度线.