
题目列表(包括答案和解析)
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |

| ||
| ||
| 162.5cV |
| m |
| 162.5cV |
| m |
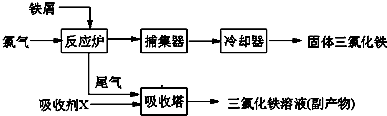
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,![]() 该过程可用离子方程式表示为: ▲ 。
该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3??6H2O的方法是: ▲ 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32—=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)用FeCl3溶液(32%~35![]() %)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+;
阴极反应为: ▲ 。
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
▲ 。
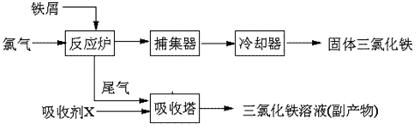
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
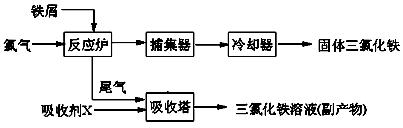
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com