
题目列表(包括答案和解析)
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为FeSO4·(NH4)2SO4·6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100 g水)如下表:

下图是模拟工业制备硫酸亚铁铵晶体的实验装置.

回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是________________.
(2)将处理好的铁屑放人锥形瓶中,加人稀硫酸.锥形瓶中发生反应的离子方程式可能为________________ (填序号).
A.Fe+2H+=Fe2++H2↑
B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞________,打开活塞________(填字母).容器③中NaOH溶液的作用是________________;向容器①中通入氢气的目的是________________.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是_____________;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是________、________、________________.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液.用0.5 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4-被还原成Mn2+时,耗KMnO4溶液体积20.00 mL.
滴定时,将KMnO4溶液装在________(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为________________;晶体中FeSO4的质量分数为________.

(分)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质且利用率较高。合成路线如下:
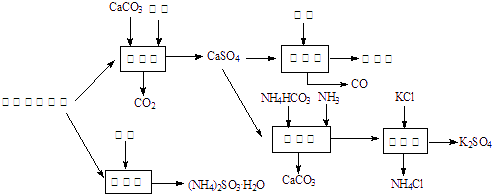
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑵下列有关说法正确的是_______________。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70 ℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25 ℃,硫酸钾的产率超过90%,其原因是_________________________。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,若某尾气含标准状况试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________。
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
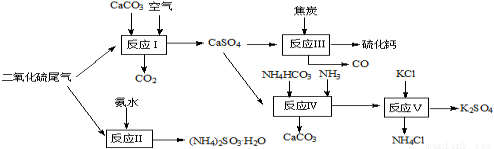
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液.
(2)已知铅蓄电池放电时发生如下反应:
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
本卷分第1卷(选择题)和第1I卷。
第Ⅰ卷共18题,每小题6分,共108分。
一、选择题:选对的给6分,选错或未选的给0分。
1.D 2.A 3.C 4.D 5.B 6.D
7.D 8.C 9.B 10.C 11.D 1 2.B
二、选择题:全部选州的给6分,选对但不全的给3分,有选错或未选的给0分。
13.B 14.AB 15.D 16.C 17.C 18.CD
 第Ⅱ卷必考部分共9题,共157分。
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1) CE (4分)
(2) ①如右图所示(6分)
②1 500(4分) 0.90(4分)
20.(15分)
解:设甲车刹下后经时间t,甲、乙两车速度相等,则:
 ①
①
 ②
②
 ③
③
 ④
④
 ⑤
⑤
联立以上各式得:

21.(19分)
解:一个运动周期时间为4秒,、半个周期t=2秒
物体所受到的摩擦力大小为: 
前2秒内物体的加速度: 
2―4秒物体的加速度:

前4秒的位移大小: 
第84秒的位移 
83抄时的速度 
83.秒内的位移大小:

83.秒内外力F对物体做的功为:

22.(20分)
解:
(1) 设带电粒子在磁场中做匀速圆周运动的半径为R、周期为T,带电粒子在磁场中做匀速圆周运动,洛伦兹力提供向心力,有  (2分)
(2分)
而周期  (2分)
(2分)
由以上两式可得 (2分)
(2分)
说明带电粒子在磁场中做匀速圆周运动的周期与磁场方向变化的周期
相等,当带电粒子运动在PQ直线时,磁场反向,只要PQ之间的距离

 时,带电粒子均能到达Q点与中性粒子相碰撞,所以
时,带电粒子均能到达Q点与中性粒子相碰撞,所以  (2分)
(2分)
即 (2分)
(2分)
同时有 
 (2分)
(2分)
当 200V时,
200V时, =3,带电粒子能与中性粒子相碰撞。 (1分)
=3,带电粒子能与中性粒子相碰撞。 (1分)
(2)如右上图(3分)
(3)能使带电粒子与中性粒子碰撞,加速电压的最大值由  可知,当
可知,当  时,即
时,即 450V
(4分)
450V
(4分)
23.(20分)
(1)  (4分)
(4分)
(2) ①>②>④>③ 6×10-10 (每空2分,共4分)
(3) 10.6 100ml容量瓶 (每空2分,共4分)
(4)① (2分)
(2分)
② 反应② 废弃物利用, 有利于环保(合理即可)(每空2分,共4分)
③ ①减小. ②有利 (每空2分,共4分)
24.(10分)
(1)  (2分)
(2分)
(2)  (2分)
(2分)
(3) 
H-放电促进了水的电离OH-浓度增大 B (每空2分,共6分)
25.(15分)
(1) 向色固体变黑色; (2分)
(2) 测量生成氧气的体积; (2分)
(3) 不正确。因为氧气也能与B中的溶液发生反应; (3分)
(4) 没必要。因为气体通过E后,又混入了水分; (3分)
(5) 二氧化硫为0.02mol,三氧化硫为0.01mol; (每空1分,共2分)
 (3分)
(3分)
26.(26分)
I (8分)
(1) 不理想,因为该细胞叶绿体中含有颜色较深的叶绿素等色素,鉴定时对颜色反应
起着干扰作用。 (3分)
 (2) (3分)
(2) (3分)
(3) ①(2分)
II(18分)
(1)9 4 (4分)
(2) 按种相应的病原体 全部感病(或非糯感病)HHrr
抗病和感病(或非糯抗病和非糯感病) HHRR、HHRr、HHrr (10分)
(3) 基因突变 HHRr (4分)
27.(14分)
(1) 染色体的运动是由于纺锤丝的牵引
(4) ①分裂期②染色体的运动情况
(5) ①其一是,该实验要观察活细胞染色体的运动,不能解离和漂洗:其二是,缺少对照组,应添加一组不加秋水仙素的对照组。
②A.滴加一定浓度的秋水仙素溶液,能抑制纺锤体形成,染色体将不再运动,说明染色体的运动是由于纺锤丝的牵引;
B.滴加一定浓度的秋水仙素溶液,能抑制纺锤体形成,染色体仍能运动,说明染色体的运动不是由于纺锤丝的牵引。
第1I卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、
为化学题,考生从两道物理题、两道化学题中各任选一题做答,若第28、29题
都作答,则按第28题计分,若第30、31题都作答,则按第30题计分,第32题
为生物题,是必答题。
28.(12分)
(1) ③ (2) ② (各6分,共12分)
29.(12分)
(1) ③ (2) ④ (各6分,共12分)
30.(13分)(1) 4(2分) 8(2分)XY2(或Y2X) (3分)
(2) 12 (3分)
(3)
31.(13分)
(1) C9Hl00 消去反应(再2分) (2)HCOOH,
 (各3分)
(各3分)
32.(10分)
(1) 限制酶、DNA连接酶 显微注射法
(2) 胚胎分割移植(胚胎分割和胚胎移植)
(3) 全能性高 植物组织培养
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com