
题目列表(包括答案和解析)
某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
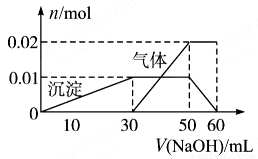
下列说法不符合事实的是( )
A.根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L
B.根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L
C.另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀
D.NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3
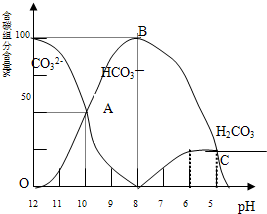 常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:
常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:实验室需要0.1mol/LNaOH溶液450mL 和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为__________g。配制时,其正确的操作顺序是字母表示,
每个字母只能用一次)____________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/ 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算
结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用____________mL的量筒最好。
实验室需要0.1mol/LNaOH溶液450mL 和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。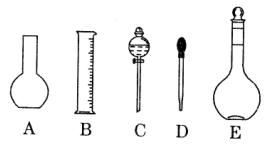
(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为__________g。配制时,其正确的操作顺序是字母表示,
每个字母只能用一次)____________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/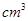 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算
结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用____________mL的量筒最好。
将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)![]() 2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
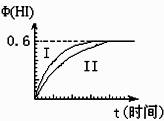
(1)达平衡时,I2(g)的物质的量浓度为 mol?L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线
(I)所示,则该条件可能是 (填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为 (用一个含a、b、c的代数式表示)。
(4)室温时将0.01 mol HI气体溶于水配成100 ml溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为 mol?L-1 ;若降低温度该溶液的pH值将 (填增大、减小或不变)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com