
题目列表(包括答案和解析)
考生从两道化学题中各任选一题作答
1[化学——物质结构与性质]Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是___________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的_________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为_________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为_________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于_________(填晶体类型)。
2[化学——有机化学基础]有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: 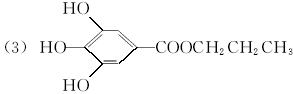 (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为________________。
(2)官能团—X的名称为____________,高聚物E的链节为____________。
(3)A的结构简式为________________________。
(4)反应⑤的化学方程式为____________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式。
ⅰ.含有苯环 ⅱ.能发生银镜反应 ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系: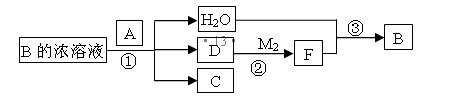
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
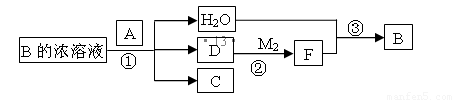
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。


| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com