(2012?顺义区二模)硫酸铝铵常用于水的净化以及工业水的处理.硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随温度升高、脱去结晶水,产生晶变.工业用铝土矿(主要成分Al
2O
3、少量SiO
2、Fe
2O
3、MgO等)为原料制取硫酸铝铵的工艺流程示意图如下:
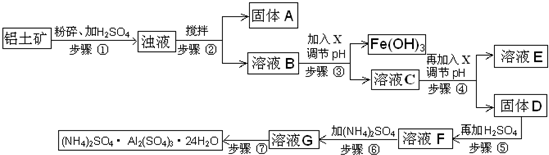
部分氢氧化物沉淀的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
3.8 |
2.7 |
9.4 |
| 完全沉淀pH |
5.2 |
3.2 |
12.4 |
请回答下列问题:
(1)步骤③中调节pH使Fe(OH)
3沉淀完全,检验Fe
3+是否沉淀完全的操作是
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
.
(2)若X为NaOH,步骤④中发生反应的离子方程式是
Al3+﹢3OH-=Al(OH)3↓
Al3+﹢3OH-=Al(OH)3↓
.
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
.
(4)硫酸铝铵水溶液呈酸性的原因是
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
(用离子方程式表示).浓度均为0.1mol/L硫酸铝和硫酸铝铵两种水溶液,c(Al
3+) 较大的是
硫酸铝铵
硫酸铝铵
(填“硫酸铝铵”或“硫酸铝”)溶液.
(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
.
(6)步骤⑦的操作方法包括
冷却,结晶、过滤、洗涤、干燥
冷却,结晶、过滤、洗涤、干燥
.

 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: