
题目列表(包括答案和解析)
 ,其含苯环的同分异构体共有
,其含苯环的同分异构体共有
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
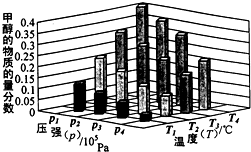
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)

A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
(每空2分,共14分)根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:_____________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 。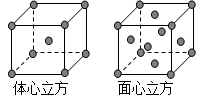
(每空2分,共14分)根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:_____________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为: ,SO2的立体结构为: 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com